Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
新井 栄揮; 米澤 悌*; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
no journal, ,
中度好塩菌 sp.593のペリプラズム蛋白質Alkaline phosphatase(HaALP)は、他の好塩性Alkaline phosphataseと異なり、幅広い塩濃度域(1
sp.593のペリプラズム蛋白質Alkaline phosphatase(HaALP)は、他の好塩性Alkaline phosphataseと異なり、幅広い塩濃度域(1 4M NaCl)において機能発現が可能である。そこで本研究では、HaALPの構造学的特徴と好塩性の関係を理解するために、HaALPのX線結晶解析を行った。分解能2.1
4M NaCl)において機能発現が可能である。そこで本研究では、HaALPの構造学的特徴と好塩性の関係を理解するために、HaALPのX線結晶解析を行った。分解能2.1 、空間群
、空間群 2
2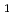 、格子定数
、格子定数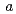 =52.7
=52.7 ,
, 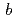 =147.0
=147.0 ,
, 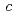 =58.3
=58.3 ,
,  =90
=90 ,
,  =105.2
=105.2 ,
,  =90
=90 , R
, R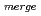 8.4%の回折データを取得して、生物学的構造単位であるHaALP二量体の立体構造を解明することに成功した。また、HaALPの立体構造を、PDB中で最も配列相同性が高い低度好塩菌
8.4%の回折データを取得して、生物学的構造単位であるHaALP二量体の立体構造を解明することに成功した。また、HaALPの立体構造を、PDB中で最も配列相同性が高い低度好塩菌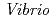 sp.由来VALP (identity 70.0%)の立体構造と比較した。その結果、ASA
sp.由来VALP (identity 70.0%)の立体構造と比較した。その結果、ASA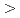 0
0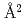 の酸性アミノ酸(D, E)の数は、VALP (57個)よりもHaALP (72個)が多いことが明らかになった。また、VALPとHaALPを構成する疎水性アミノ酸(V, L, I, P, F, M, W)に着目すると、二量体界面に位置する疎水性アミノ酸の数はほぼ同じ(39個と40個)であったが、分子内部(ASAが0
の酸性アミノ酸(D, E)の数は、VALP (57個)よりもHaALP (72個)が多いことが明らかになった。また、VALPとHaALPを構成する疎水性アミノ酸(V, L, I, P, F, M, W)に着目すると、二量体界面に位置する疎水性アミノ酸の数はほぼ同じ(39個と40個)であったが、分子内部(ASAが0 )の疎水性アミノ酸はそれぞれ24個と37個であった。このようなHaALPにおける分子表面の高い酸性アミノ酸含量や分子内部の高い疎水性アミノ酸含量は、中度好塩菌のペリプラズム特有の幅広い塩濃度環境下(0.5M
)の疎水性アミノ酸はそれぞれ24個と37個であった。このようなHaALPにおける分子表面の高い酸性アミノ酸含量や分子内部の高い疎水性アミノ酸含量は、中度好塩菌のペリプラズム特有の幅広い塩濃度環境下(0.5M 飽和塩濃度)における高い可溶性と機能発現の両立に寄与していると考えられる。
飽和塩濃度)における高い可溶性と機能発現の両立に寄与していると考えられる。
安達 基泰; 清水 瑠美; 黒木 良太; 森谷 圭介*; 城所 俊一*; 日高 興士*; 津田 裕子*; 木曽 良明*
no journal, ,
エイズ治療の創薬標的タンパク質であるHIV-1プロテアーゼ(HIVPR)の阻害剤開発において、薬剤耐性に有効な阻害剤設計のためには、阻害剤複合体及び基質複合体の立体構造の特徴と、速度論的・熱力学的解析より得られるパラメーターの相関の解明が必要である。本研究では、一本鎖化したHIVPR(scHIVPR)及びA17型薬剤耐性変異体(scA17-HIVPR)を利用することにより、Asp25のみをAsnに置換したD25N-scHIVPR及びD25N-scA17-HIVPRを作製した。D25N-scHIVPR及びD25N-scA17-HIVPRの阻害剤複合体の結晶を使い、放射光施設(PF)において、それぞれ1.1 及び1.5
及び1.5 分解能の回折データを収集した。立体構造を精密化した結果、いずれの酵素においても阻害剤との相互作用を確認できた。導入したAsnの側鎖のアミノ基は、阻害剤のカルボニル基と水素結合していた。
分解能の回折データを収集した。立体構造を精密化した結果、いずれの酵素においても阻害剤との相互作用を確認できた。導入したAsnの側鎖のアミノ基は、阻害剤のカルボニル基と水素結合していた。
清水 瑠美; 安達 基泰; 黒木 良太; Blaber, M.
no journal, ,
ヒト線維芽細胞増殖因子(hFGF)の立体構造情報をもとにして創製した、三回繰り返し配列を有する人工タンパク質(Symfoil)に関して、さらに高い分解能による立体構造情報の取得を目指している。今回、Symfoilの化学的に不安定な配列の除去と繰り返し配列の完全性の向上したSymfoil改変体(Symfoil-II)を設計した。Symfoil-IIは、大腸菌を用いて可溶性分画に発現させた後、Niキレートカラムにより精製し、さらにプロテアーゼ消化によってHisTagを除去したものを陰イオン交換HPLCにより精製した。その後Symfoilの二次構造形成を円偏光二色性スペクトルで確認した。精製試料の収量は、培地1Lあたり約15mgであった。精製したSymfoil-IIは、Symfoilと同様の結晶化条件(1.8M (NH )
) SO
SO , 0.1M TrisHCl pH7.0)で結晶化した。実験室系のX線回折計による予備実験によって1.9
, 0.1M TrisHCl pH7.0)で結晶化した。実験室系のX線回折計による予備実験によって1.9 分解能の回折データを取得し、分子置換法で位相を決定した結果、Symfoilとは異なる結晶内分子パッキングを持つが、同様の高い対称性立体構造を有することがわかった。
分解能の回折データを取得し、分子置換法で位相を決定した結果、Symfoilとは異なる結晶内分子パッキングを持つが、同様の高い対称性立体構造を有することがわかった。
 -エンドグルカナーゼの結晶構造解析
-エンドグルカナーゼの結晶構造解析有森 貴夫*; 伊藤 彰紘*; 中澤 昌美*; 上田 光宏*; 玉田 太郎
no journal, ,
植物バイオマスを糖化する際、従来の高温条件下ではなく、低温条件下で効率よく糖化できれば、加温するためのエネルギーを節約することができる。最近われわれは、シマミミズ由来1,4- -エンドグルカナーゼ(EF-EG2)のクローニングに成功した。本酵素は、40
-エンドグルカナーゼ(EF-EG2)のクローニングに成功した。本酵素は、40 において最大活性を示すが、低温(20
において最大活性を示すが、低温(20 C)条件においても比較的高い活性を保持する。EF-EG2は、456アミノ酸残基から構成される約50kDaの酵素であり、GHファミリー9に属するタカサゴアリ由来の1,4-
C)条件においても比較的高い活性を保持する。EF-EG2は、456アミノ酸残基から構成される約50kDaの酵素であり、GHファミリー9に属するタカサゴアリ由来の1,4- -エンドグルカナーゼ(NTEgl)と高いアミノ酸配列相同性(55%)を有している。われわれは、EF-EG2が低温においても高い活性を保持する機構を立体構造情報から理解することを目的に、EF-EG2の結晶構造解析に取り組んだ。酵母を用いた組換え型酵素の発現系を構築し、引き続き試料精製、結晶化スクリーニング、結晶化条件の最適化を実施した結果、回折実験可能な針状のEF-EG2結晶を得ることに成功した。この結晶を用いて放射光施設において、2.1
-エンドグルカナーゼ(NTEgl)と高いアミノ酸配列相同性(55%)を有している。われわれは、EF-EG2が低温においても高い活性を保持する機構を立体構造情報から理解することを目的に、EF-EG2の結晶構造解析に取り組んだ。酵母を用いた組換え型酵素の発現系を構築し、引き続き試料精製、結晶化スクリーニング、結晶化条件の最適化を実施した結果、回折実験可能な針状のEF-EG2結晶を得ることに成功した。この結晶を用いて放射光施設において、2.1 分解能の回折データを収集し、引き続き既知のNTEglの構造情報を用いた分子置換法による位相決定、及び構造精密化を完了した。EF-EG2の全体構造は、一般的なGH9酵素と同様、(
分解能の回折データを収集し、引き続き既知のNTEglの構造情報を用いた分子置換法による位相決定、及び構造精密化を完了した。EF-EG2の全体構造は、一般的なGH9酵素と同様、( /
/ )
)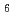 バレル構造をしていたが、糖結合部位付近の構造には他のGH9酵素との構造とわずかな相違がみられた。本発表では、得られたEF-EG2の立体構造と他のGH9酵素の立体構造との詳細比較から、EF-EG2の活性発現及び低温耐性機構について議論したい。
バレル構造をしていたが、糖結合部位付近の構造には他のGH9酵素との構造とわずかな相違がみられた。本発表では、得られたEF-EG2の立体構造と他のGH9酵素の立体構造との詳細比較から、EF-EG2の活性発現及び低温耐性機構について議論したい。
小坂 恵*; 金尾 忠芳*; 中山 久之*; 吉田 京矢*; 上村 一雄*; 高田 潤*; 山田 秀徳; 玉田 太郎; 岡崎 伸生*; 黒木 良太
no journal, ,
テトラチオン酸加水分解酵素(tetrathionate hydrolase)は、pH2以下の強酸性環境下でも生育できる好酸性化学合成独立栄養細菌の一種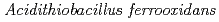 に由来する。本酵素は、硫黄を酸化するエネルギーで生育する
に由来する。本酵素は、硫黄を酸化するエネルギーで生育する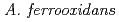 の異化的硫黄代謝において重要な役割を果たしており、他の細菌には類を見ない
の異化的硫黄代謝において重要な役割を果たしており、他の細菌には類を見ない 属細菌に特徴的な酵素である。また、それが触媒する反応も極めてユニークである。われわれは本酵素を生成し、これをコードする遺伝子を同定したが、推定される一次構造は極めて特異的であり、相同性が高いものでも15%程度であり、データベースからの機能推定が不可能である、新規な一次構造を持つタンパク質であった。われわれはこの遺伝子を大腸菌に導入し、組み換え発現、リフォールディング、精製により結晶化に成功した。SPring-8での測定で回折データを収集し、構造解析を行っている。
属細菌に特徴的な酵素である。また、それが触媒する反応も極めてユニークである。われわれは本酵素を生成し、これをコードする遺伝子を同定したが、推定される一次構造は極めて特異的であり、相同性が高いものでも15%程度であり、データベースからの機能推定が不可能である、新規な一次構造を持つタンパク質であった。われわれはこの遺伝子を大腸菌に導入し、組み換え発現、リフォールディング、精製により結晶化に成功した。SPring-8での測定で回折データを収集し、構造解析を行っている。
黒木 良太
no journal, ,
タンパク質の複雑な構造と機能の解明は、生命現象の分子的理解を求める科学の発展に貢献するだけでなく、高機能のタンパク質創製を通じで産業の発展にも貢献する。水素原子のような軽元素の観測を得意とする中性子は、タンパク質の構造を決定する手段としてはまだ一般的なものとは言えないが、諸外国において整備が進む中性子ビームラインの利用によって、今後の蛋白質科学の重要な研究ツールの一つになると期待される。現在建設が進むタンパク質の構造解析に用いられる中性子ビームラインのほとんどが共同利用を目的としているが、日本国内には先の震災以降停止中の原子力機構・研究用原子炉の定常炉中性子ビームラインと大強度陽子加速器施設(J-PARC)に茨城県が設置した産業利用目的のビームラインの一部が利用可能だけであり、放射光施設のように一般の研究者が課題申請によって利用できるビームラインは大変少ない。そこでわれわれは国内のすべての研究者がビーム利用申請によって公平にアクセスでき、さらに諸外国のビームラインと異なりタンパク質の立体構造解析に特化した専用ビームラインの建設計画を進めている。本ワークショップでは、現在の中性子タンパク質結晶学の現状を総括するとともに、タンパク質解析専用共同利用ビームラインの建設実現への取り組みを紹介する。